이전 글에서 VSEPR에 관해 다루었다.
단계에 맞게 루이스 구조를 결정하는 과정이
너무 길어져서 따로 작성하려 한다.
루이스 구조를 결정하는 과정은
아래 글을 참고하면 된다.
[무기화학] VSEPR 0단계 (루이스 구조식)
점군을 결정하기 위해서는 분자의 모양을 정확히 알아야 한다. 분자 모양에 따라 점군이 달라지기 때문이다. 이미 VSEPR을 마스터해서 다음 스텝인 점군을 알고 싶다면 다음 글을 참고하자. [무기
about-chemistry.tistory.com
다시 한 번 상기시켜 보자.
루이스 구조를 결정하는 단계는 다음과 같았다.
1. 중심 원자 결정
2. 중심 원자의 최외각 전자 수 결정
3. 단일 결합으로 연결
4. 남은 전자, 부족 전자 해결
5. 옥텟 만족 확인
이렇게만 보면 이해가 안 될 것이다.
쉬운 분자들은 이전 글들을 통해 확인하고,
이번 글부터는 난이도를 높여 예를 들어보겠다.
(그렇게 어렵지만은 않으니, 천천히 읽도록 하자.)
온실 가스로 유명한 이산화탄소.
CO2를 생각해보자.
탄소는 4개의 결합을 할 수 있는,
대표적인 중심 원자이다.
많은 결합을 할 수 있기 때문이다.
그래서 우리는 탄소를 중심 원자로 설정한다.
이렇게 1단계를 완료했다.
2단계인 중심 원자의 최외각 전자 수를
결정해보도록 하자.
탄소는 14족으로, 최외각 전자 4개를 가졌다.
생각보다 더 간단하게 2단계까지 마쳤다.
3단계를 진행하기 위해 원자들을
단일 결합으로 연결해보도록 하자.
중심에 탄소를 배치하고
그 주변으로 산소를 배치한다.
그리고 단일 결합으로 연결한다.
그러면 다음과 같은 구조를 얻을 수 있다.

주변 원자의 비공유 전자쌍까지 그려보았다.
(이 과정에서 주변 원자의 비공유 전자쌍까지
고려해서 구조를 그려보는 것을 추천한다.)
4단계. 남은 전자, 부족 전자를 해결해보자.
중심 원자인 탄소의 최외각 전자는 4개이다.
그리고 단일 결합을 함으로써 탄소의
최외각 전자 2개가 사용되었다.
그럼 탄소의 최외각 전자는 몇 개가 남았을까?
아주 당연하게 2개가 남았다.
————[여기서 잠깐!]————
남은 전자를 처리하는 방법은 두 가지가 있다.
1) 이중 결합을 형성하는 것
2) 비공유 전자쌍을 형성하는 것
이 때 고려해야 할 부분이 있다.
바로 옥텟 규칙을 만족해야 한다는 것이다.
(앞서 살펴본 BH3 같이 예외도 있다.)
———————————————
그러면 다시 이산화탄소 분자를 생각해보자.
중심 원자인 탄소의 남은 최외각 전자들을
어떻게 해결할지 고민해보자.
1) 비공유 전자쌍을 형성한다고 가정해보자.
그러면 다음과 같은 구조가 된다.

뭔가 이상하다고 느껴지지 않는다면,
아직 루이스 구조가 익숙하지 않은 것이다.
비공유 전자쌍은 전자 2개로 구성된다.
비공유 전자“쌍”으로 불리는 데 이유가 있다.
그러니 위의 구조는 이상하다고 보는 게 맞다.
그러면 다른 방법을 통해 탄소의
최외각 전자를 해결해야 한다는 말이다.
2) 이중 결합을 형성한다고 가정하자.
산소의 전자 하나와 탄소의 전자 하나가
서로 공유 결합을 형성하면서
이중 결합을 형성한다고 생각하면 된다.
그러면 다음과 같은 구조를 그릴 수 있다.
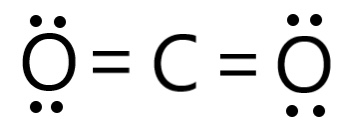
5단계. 옥텟 규칙을 만족하는지 확인하자.
탄소를 중심으로 전자 8개,
산소를 중심으로 전자 8개가 배치되었다.
탄소와 산소 모두 옥텟 규칙을 만족한다.
이렇게 루이스 구조를 결정할 수 있다.
* 수정해야 할 개념, 혹은 표현이 있다면, 댓글에 달아주시면 감사하겠습니다. *
'무기화학 > 대칭성과 분자 구조' 카테고리의 다른 글
| [무기화학] VSEPR 0단계 (SF4 루이스 구조) (0) | 2023.05.15 |
|---|---|
| [무기화학] VSEPR 0단계 (SF6 루이스 구조) (0) | 2023.05.11 |
| [무기화학] VSEPR 0단계 (BH3 루이스 구조) (0) | 2023.05.04 |
| [무기화학] VSEPR 0단계 (H2O 루이스 구조) (0) | 2023.05.01 |
| [무기화학] VSEPR 0단계 (루이스 구조식) (0) | 2023.04.27 |


댓글