열역학에서는 '계의 내부에너지가 관심 사항'이라는 것을 기억하며 다음 내용으로 넘어가자. 간단히 말하자면, 열역학에서 내가 관찰하고자 하고자 하는 영역을 '계'라고 한다. (이와 관련하여 작성해둔 글이 있으니 참고하면 된다.)
[일반화학] 계와 주위, 그리고 우주 (feat. 계의 종류)
실험을 진행할 때 내가 주의깊게 관찰해야 하는 영역과 그렇지 않은 영역이 존재한다. 관심 있게 관찰하는 영역을 '계(system)'라고 하며, 그렇지 않은 영역을 '주위(surroundings)'라고 한다. 그리고
about-chemistry.tistory.com
우리는 관심 있는 그 계의 내부에너지에 관심이 있다는 말이다. 그렇다면 내부에너지(U)는 무엇일까?
내부에너지(U)는 여러 형태로 나타나는 에너지이다. 예를 들면, 분자의 병진에너지, 계를 이루는 구성물의 퍼텐셜 에너지, 분자 간 상호작용의 퍼텐셜 에너지 등이 있다.
즉, 관심 계에 대한 이런 모든 형태의 전체 에너지를 기호 U로 나타내고 '내부에너지'라고 한다.
계와 주위 둘 모두의 에너지를 고려할 때 에너지가 창조되거나 소멸될 수 없다는 경험에 기반을 둔 열역학 제 1법칙이 있다. 이 열역학 제 1법칙은 여러 형태로 공식화될 수 있다.
<열역학 제 1법칙>
고립계의 내부에너지 U는 일정하다. → △U(전체) = △U(계) + △U(주위) = 0
△U(계) = -△U(주위)
(사실 우주의 잔여 부분을 주위로 정의하는 것을 실질적이지 못하다. 왜냐하면 전 우주를 관찰하는 것은 비현실적이기 때문이다. 일반적으로 우주에서 계와 가까운 부분만이 계와 상호작용한다는 것을 경험상 알고 있다.)
우리가 관심있는 이 계의 내부에너지가 변하는 것도 우리가 주의깊게 관찰해야 한다. 그렇다면 이 계의 내부에너지는 어떻게 변화될까?
이는 경험적으로 열(q)이나 일(w) 또는 이 둘의 조합으로만 분류될 수 있음을 알 수 있다. 이를 적용하게 되면 아주 유용한 공식을 얻을 수 있다.
△U(계) = q + w
이제부터 계에 관한 내부에너지는 (계)를 생략하여 작성하도록 하겠다.
열과 일, 혹은 이 둘의 조합으로 내부에너지를 설명할 수 있다는 것은 받아들였다고 하자. 그러면 열과 일을 보다 자세히 알 필요가 있을 것이다. 우리는 계의 내부에너지에 관심이 있고, 그 내부에너지를 변화시키는 요인들이 열과 일이기 때문이다.
먼저 일(w)에 관해 알아보도록 하자.
계와 주위 사이의 경계를 통하여 "흐르는" 에너지의 양으로서 일(work)을 정의한다.
그렇다면 일의 양은 어떻게 계산할 수 있을까?

외부압력을 딛고 나가는 힘 = 일이므로, 일의 크기를 '외부압력'이 결정한다. 따라서 일을 다음과 같이 계산할 수 있다.

이 때 외부압력은 계의 내부압력과 같을 필요는 없다.
이제 열에 관해 알아보도록 하자.
계와 주위의 온도 차에 따라 계와 주위 사이 경계를 통하여 흐르는 에너지의 양으로 열(heat)을 정의한다.
계와 주위가 열적평형에 있을 때 계의 온도가 증가하면 주위의 온도도 증가한다. 이를 일반화하여, 일정한 조성의 균일한 단일상 계에 대해 U는 단조적으로 증가하는 T의 함수라고 말할 수 있다. 따라서 △T > 0이므로 △U > 0이다.
다음으로 주위에 관해 생각해보자. 열역학 제 1법칙에 따라 △U = -△U(주위) < 0이다. 이 때 힘이 주어지지 않았다고 한다면, w = 0이다. 따라서 △U > 0, q > 0, q(주위) < 0이다.
우리는 계의 내부에너지에 관심을 가지고 관찰을 하고 있다. 그렇다면 계의 내부에너지를 결정하는 열과 일을 계산하고 싶은 것은 당연하다. 위에서 일을 계산하는 방법을 알아보았으니, 이번에는 열을 계산하는방법에 관해 알아보려 한다.
열 흐름에 대한 계의 열적 반응을 열용량이라고 하는 매우 중요한 열역학적 성질에 의해 기술될 수 있다. 이 열용량은 한 물질의 온도를 일정량만큼 변화시키는데 필요한 에너지 척도이다.
이 문장을 통해 열용량 단위를 예측해보자.
“온도를 일정량만큼 변화시키는데 필요한
에너지 척도"
에너지 척도에 관한 것이므로 에너지 단위인 J이 분자에 위치할 것이다. 온도 당 올리는데에 필요한 에너지이니까 온도 단위인 K은 분모에 위치할 것이다. 따라서 열용량의 단위는 J/K이다.
(단위 시간 당 간 거리인 속력의 단위는 m/s인 것과 마찬가지이다.)
이러한 열용량은 일정 압력일 때, 혹은 일정 부피일 때라는 조건에 따라서 일정 압력 열용량 Cp, 일정 부피 열용량 Cv로 표현할 수 있다. 이를 이용하여 우리가 원하는 열을 계산할 수 있다.
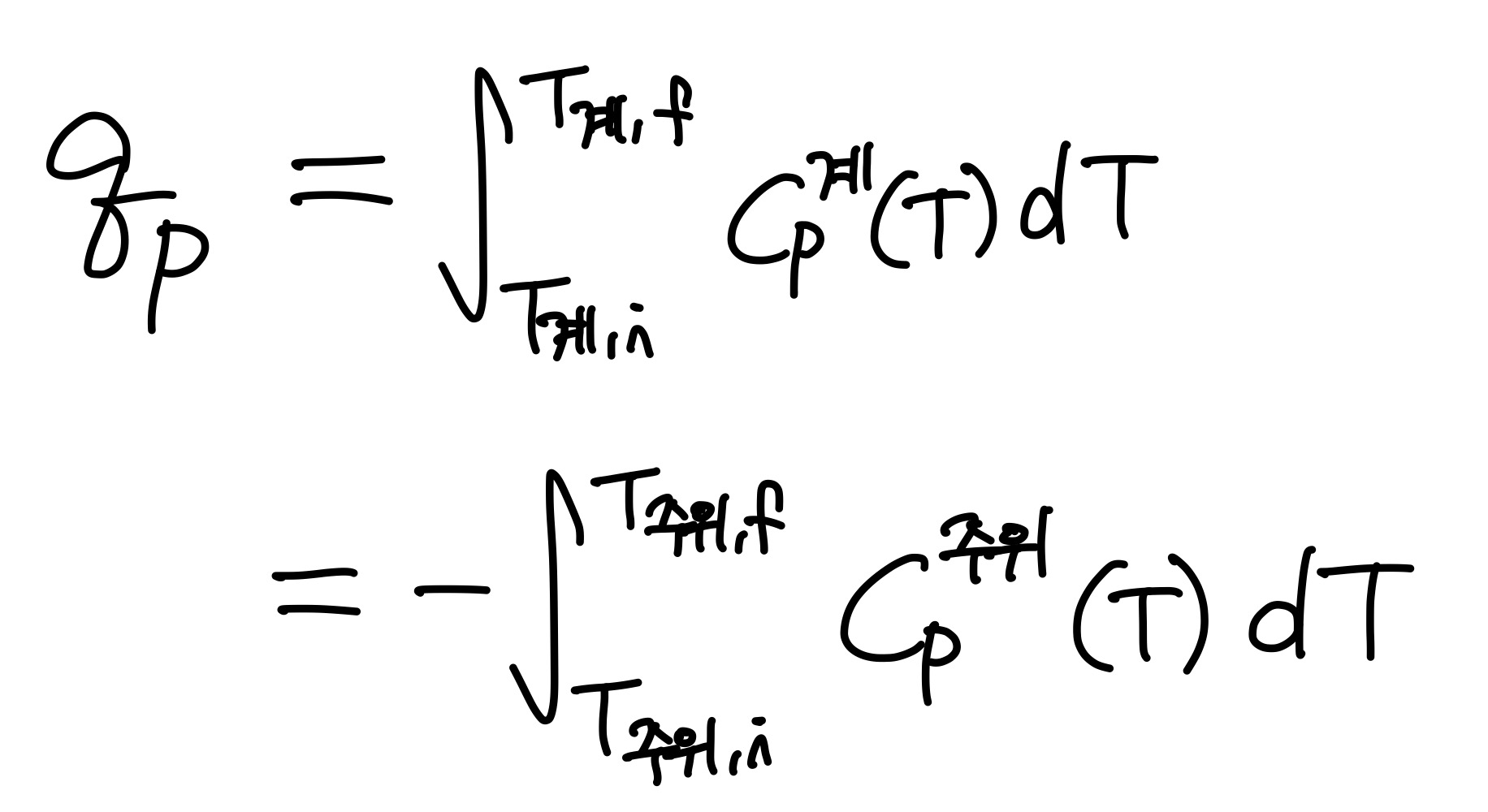
지금까지 열과 일에 관해 알아보았다. 마지막으로 열과 일의 공통점을 알아보며 이 글을 마무리하려 한다.
열과 일은 상태함수라는 공통점이 있다. 우리가 관심을 가지고 있는 내부에너지는 경로함수이다.
+) 상태함수와 경로함수는 무엇일까? 간단히 말하자면 경로에는 무관하고, 오직 처음과 마지막 상태에만 의존하는 함수가 상태함수이다. 내부에너지가 그 예가 된다. 경로함수는 계의 경로에 의존하는 함수라고 할 수 있다. 경로에 따라서 다른 값을 가지는 함수인 것이다. 열과 일이 경로함수의 예이다.
이렇게 상태함수이냐, 경로함수이냐에 따라 완전미분인지 아닌지가 결정된다.
* 수정해야 할 개념, 혹은 표현이 있다면, 댓글에 달아주시면 감사하겠습니다. *


댓글