점군을 결정하기 위해서는 분자의 모양을 정확히 알아야 한다.
분자 모양에 따라 점군이 달라지기 때문이다.
이미 VSEPR을 마스터해서 다음 스텝인 점군을 알고 싶다면 다음 글을 참고하자.
[무기화학] 점군(point group)
무기화학에서 가장 기본적인 개념이 점군일 것이다. 아, 점군을 처음 들어볼 수 있다. 점군은 '대칭성이 비슷한 모양들을 모아서 그룹 지어둔 것'이라 생각하면 편하다. 무기화학에서 착물을 아
about-chemistry.tistory.com
이제 VSEPR을 결정하는 마지막 단계이다.
바로, 분자 구조를 결정하는 것이다.
루이스 구조식을 그리고 그 구조를 보고 입체수를 결정하는 단계까지 진행했다.
이 글에서는 입체수를 결정한 것을 토대로 분자 구조를 결정하려 한다.
입체수를 결정한 것을 바탕으로 분자 구조를 결정하는 단계라고 보면 된다.
입체수에 따른 분자 구조를 외워야 할까?
내 개인적인 생각으로는 '그렇다.'이다.
솔직히 화학이라는 학문은 외워야 하는 것이 엄청 많은 것 같지는 않다.
다른 과목들에 비해서 말이다.
그런 화학에서 외워야 하는 부분 중에 하나이지 않을까 싶다.
입체수에 따라 어떤 분자 구조를 가지는지 알고 그릴 줄 알아야 점군도 파악할 수 있다.
그래서 아래 표를 외우기를 추천한다.
아, 알고 넘어가야 하는 개념이 하나 더 있다.
전자쌍 사이의 반발력 간에 우위가 있다는 것이다.
반발력 : 비공유 - 비공유 > 비공유 - 공유 > 공유 - 공유
비공유 전자쌍과 비공유 전자쌍 사이의 반발력이
비공유 전자쌍과 공유 전자쌍 사이의 반발력보다 더 크다는 의미이다.
비공유 전자쌍과 공유 전자쌍 사이의 반발력이
공유 전자쌍과 공유 전자쌍 사이의 반발력보다 더 크다는 것이다.
전자쌍들은 음전하이므로 서로 밀어내려는 힘이 작용한다.
즉, 반발력이 존재한다.
따라서 서로 멀리 위치하려고 하기 때문에 멀리 배치해야 한다.
이 때, 반발력의 크기가 달라서 우선 순위가 존재한다.
서로 밀어낸다는 점과 반발력의 크기가 다르다는 점.
이 두 가지를 고려해서 전자를 배치하면 아래 표를 조금 더 잘 이해할 수 있을 것이다.
| 입체수 (SN) | 기하 구조 | 결합 각 | 예시 |
| 2 | 선형 | 180˚ | \(CO_2\) |
| 3 | 삼각평면 | 120˚ | \(SO_3\) |
| 4 | 사면체 (비공유 전자쌍 없음) |
109.5˚ | \(CH_4\) |
| 삼각 피라미드 (비공유 전자쌍 1개) |
107˚ | \(NH_3\) | |
| 굽은형 (비공유 전자쌍 2개) |
104.5˚ | \(H_2O\) | |
| 5 | 삼각쌍뿔 (비공유 전자쌍 없음) |
120˚, 90˚ | \(PCl_5\) |
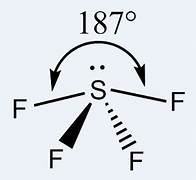
| 시소형 (비공유 전자쌍 1개) |
< 120˚ < 90˚ |
\(SF_4\) | |
| T자형 (비공유 전자쌍 2개) |
< 90˚ | \(ClF_3\) | |
| 선형 (비공유 전자쌍 3개) |
180˚ | \(XeF_2\) | |
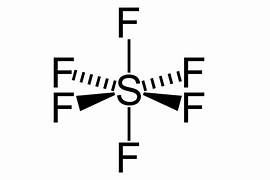
| 6 | 팔면체 (비공유 전자쌍 없음) |
90˚ | \(SF_6\) |
| 사각 피라미드 (비공유 전자쌍 1개) |
< 90˚ | \(BrCl_5\) | |
| 사각 평면 (비공유 전자쌍 2개) |
90˚ | \(XeF_4\) |
<입체 수 2>

<입체수 3>

<입체수 4>



<입체수 5>



<입체 수 6>


* 수정해야 할 개념, 혹은 표현이 있다면, 댓글에 달아주시면 감사하겠습니다. *
'무기화학 > 대칭성과 분자 구조' 카테고리의 다른 글
| [무기화학] VSEPR 1단계 (입체수 결정) (0) | 2023.05.18 |
|---|---|
| [무기화학] VSEPR 0단계 (SF4 루이스 구조) (0) | 2023.05.15 |
| [무기화학] VSEPR 0단계 (SF6 루이스 구조) (0) | 2023.05.11 |
| [무기화학] VSEPR 0단계 (CO2 루이스 구조) (0) | 2023.05.08 |
| [무기화학] VSEPR 0단계 (BH3 루이스 구조) (0) | 2023.05.04 |


댓글