3.1 작용기
3.2 알케인과 알케인 이성질체
3.3 알킬기
3.4 알케인의 명명
3.5 알케인의 성질
3.6 Ethane의 형태
3.7 다른 알케인의 형태
3.1 작용기에서는 화합물을 계열별로 분류가 가능하도록 만들어 주는 구조적 특징인 작용기에 관해 배운다. 특정 조건 하에서 반응이 일어나는 자리를 의미하는 작용기의 이름과 그 구조에 관해 기억하자.
탄소-탄소 다중 결합을 가지고 있는 작용기에는 화학 1에서도 배웠듯이 알켄, 알카인, 아렌 등이 있다. 알켄은 이중결합, 알카인은 삼중결합, 아렌은 아로마틱 고리에 해당하는 작용기이다.
탄소와 전기음성적 원자가 단일 결합을 이루고 있는 작용기 (alcohol, ether, phosphate, amine, thiol, sulfide, disulfide 등), 카보닐기를 가지고 있는 작용기 (aldehyde, ketone, carboxylic acid, ester, thioester, amide, acid chloride 등) 등에 관해 기억해두자. 뒷 장으로 갈수록 이 명명을 당연하게 사용하고 언급하기 때문이다.
뿐만 아니라 이러한 작용기의 차수에 관해 알아야 한다. 왜냐하면 차수가 안정성에 기여하는 경우가 많기 때문이다. amide의 차수, 탄화수소의 차수 등에 관해 알아두자.
3.2 알케인과 알케인 이성질체
알케인은 포화 탄화수소로, 탄소 하나 당 최대로 가능한 수의 수소를 포함하고 있다. 탄소가 가능한 많은 수소를 포함하기 위해서는 단일결합으로 이루어져 있어야 한다. 이중 결합을 이룰 경우, 포화 탄화수소보다 2개의 수소가 적어지기 때문이다. (포화 탄화수소에 비해 수소의 숫자가 적으면 불포화 탄화수소라 한다.)
알케인의 일반식은 CnH(2n+2)의 형태를 가지고 있다. 탄소 5개를 가로로 나열해보자. 그리고 그 탄소의 위, 아래에 수소를 추가해보자. 그러면 위, 아래 총 2개의 수소를 5개의 탄소에 그렸으니, 2 x 5 = 10개의 수소를 그린 것이다. 그리고 마지막으로 양 끝의 탄소는 3개의 결합을 할 수 있는 상태이므로 1개씩 총 2개의 수소를 첨가해주자. 그러면 총 2 (=위와 아래에 첨가한 수소 수) x n (=탄소 수) + 2 (양 끝의 탄소에 추가해 준 수소 수) = 2 x 5 + 2 = 12개의 수소와 결합한 것이 된다.
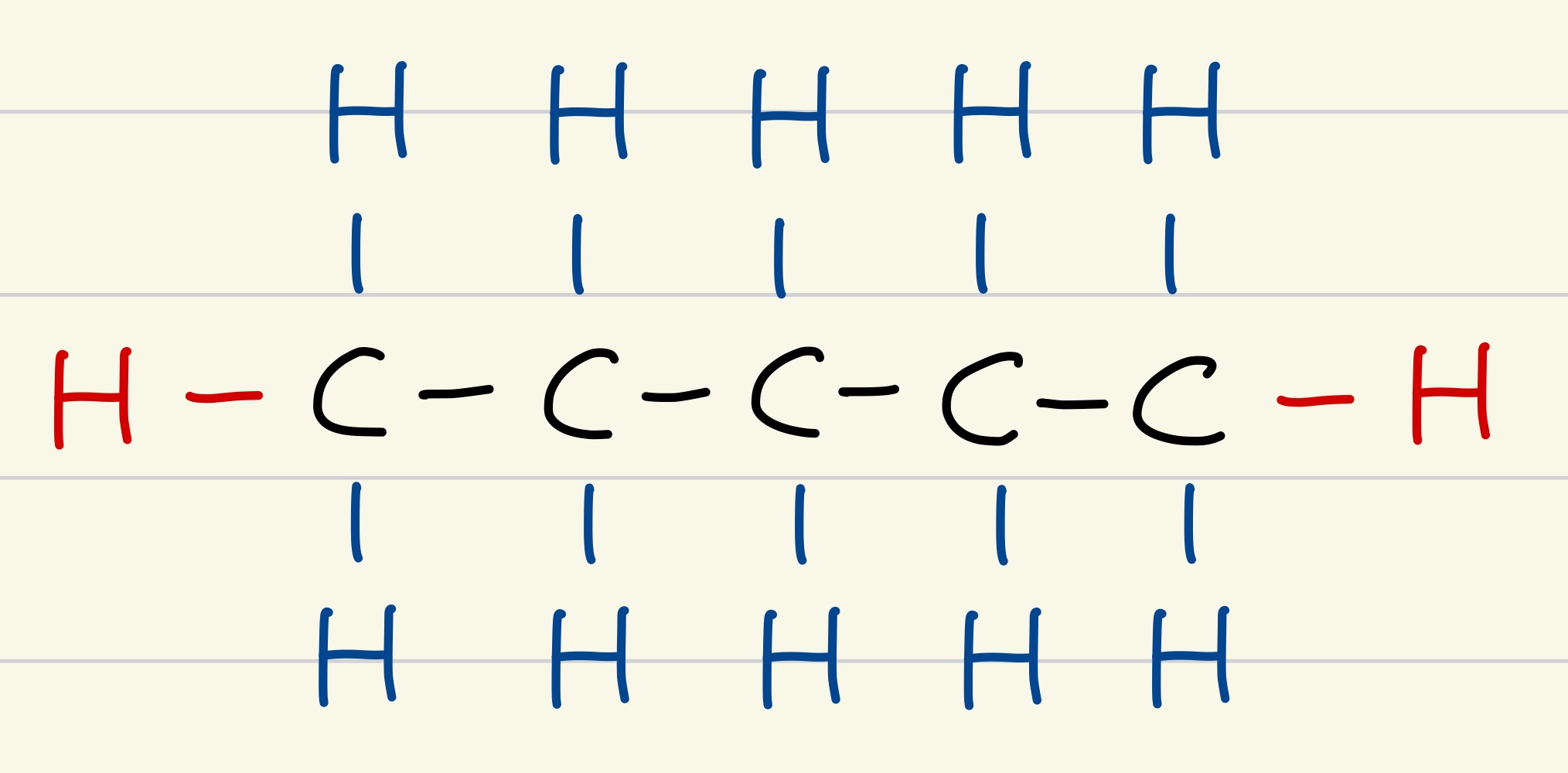
이성질체는 동일한 수와 종류의 원자를 가지지만, 원자들이 다르게 배열되어 있는 화합물을 의미한다. 그리고 구조에 따라 사슬형, 가지형, 구형 등이 존재한다. 대체적으로 사슬형이 표면적이 크기 때문에 반 데르 발스 힘이 크다. 이에 끓는점이 높다.
* 끓는점 (b.p)에 영향을 주는 요인
1) 반데르발스 힘 (VDW)
2) 쌍극자-쌍극자 힘 (D.D)
3) 수소 결합 (H.B)
이 때 극성 분자의 경우에는 위 세 가지 경우를, 비극성 분자의 경우에는 1) VDW만 고려하면 된다.
* 녹는점 (m.p)에 영향을 주는 요인
1) 대칭성 : 구형 > 고리 > 사슬 > 가지
3.3 알킬기
탄소 수가 증가함에 따라 다양한 구조를 형성할 수 있다. 이러한 탄소 구조를 관용명(일반명)으로 부르는 방법도 기억해두자. 문제에서 당연하게 이야기할 때 모르면 당황할 것이다.
3,4 알케인의 명명
정말 많은 유기 화합물들이 존재한다. 과학이 발전하고 많은 물질들을 발견하다보니, '그냥 대충 부르면 어때'를 감당하지 못하게 된 것이다. 그래서 IUPAC에서 규칙을 정해 화합물들을 명명하기 시작하였다.
1) 가장 긴 사슬 모체를 찾는다.
: 같은 길이의 두 사슬이 있다? 그러면 치환기가 많은 쪽을 모체로 정한다. 치환기가 많을수록 그 화합물을 분류할 수 있는 기준이 많아지고, 이에 명명하기 더 편해져서 그런 것이 아닐까 생각이 든다.
2) 치환기에 작은 번호가 오도록 사실에 번호를 붙인다.
그 많고 많은 유기 화합물들을 쭉 나열할 때면 아마 낮은 번호에서 큰 번호로 가는 순서로 나열할 것 같다. 그렇다면 내가 연구에 이용되고 싶은 화합물이라고 생각해보자. 내 이름이 낮은 번호가 먼저 나올수록 먼저 나열될 것이다. '과학자들의 눈에 들어 연구에 이용되고 싶다면 당연히 낮은 번호를 갖는 것을 선호하지 않을까?'라는 생각이 들었다.
3) 동일 탄소에 두 개의 치환기가 붙어 있을 경우 같은 번호를 두 번 겹쳐준다.
예를 들면 2번 자리에 methyl기가, 4번 자리 탄소에 methyl기와 ethyl기가 붙은 hexane이 있다고 가정하자. 그러면 이 hexane의 명명은 4-ethyl-2,4-dimethylhexane이 될 것이다.
4) 마지막으로 유의할 것
: 번호와 영어 사이에는 하이픈(-)을 사용한다.
: 번호 사이에는 쉼표(,)를 사용한다.
: 둘 이상의 치환기가 존재할 경우 알파벳 순서로 나열한다. 이 때 숫자를 나타내는 접두사(di, tri, tetra, penta, hexa 등)는 순위에 포함시키지 않는다. 추가적으로 차수 접두사(sec, tert 등)도 순위에 포함시키지 않지만, 모양 접두사(iso, cyclo 등)는 순위에 포함시키다. 예외적으로 차수 접두사가 순위에 포함되는 경우도 있다. 모든 경우를 고려했지만 순위가 동등할 경우에 마지막으로 차수가 다르다면, 이 때 고려해주면 된다. '뭐 이런 것이 있구나' 정도로 넘어가면 될 것 같다.
: 띄어쓰지 말고 한 단어로 쭉 연결하여 쓴다. 띄어쓰는 경우는 뒤에 나온다.
3.5 알케인의 성질
탄소수와 수소수가 많아지면 전체 연소열 (=몰 연소열)은 증가한다.
결합각 장애가 커지면 탄소 개수당 연소열 (=CH2기 당 연소열)은 증가한다.
3.6 Ethane의 형태
Newman 투영법으로 에테인을 보자. 그러면 다음과 같은 구조를 생각해볼 수 있다.
엇갈린 입체배열 (staggered 형태)
: 에테인이 가질 수 있는 구조 중 가장 안정한 형태이다. 따라서 이 구조를 0kJ/mol로 기준을 잡을 것이다. 이제 이 구조를 60도 회전시켜보자.
가리운 입체배열 (eclipsed 형태)
: 에테인이 가질 수 있는 가장 안정한 형태인 staggered 형태보다 불안정한 형태이다. 상대적으로 0kJ/mol보다 12kJ/mol만큼 불안정하다. H-H 겹침이 총 3개가 있을 때 12kJ/mol이었다. 따라서 하나의 H-H 가리움에 의한 에너지 불안정은 4kJ/mol이다. 이 구조를 다시 60도 회전시키면 엇갈린 입체배열이 나오므로 위 두 구조가 반복된다는 것을 의미한다.
3.7 다른 알케인의 형태
탄소 두 개로 생각하면 비교적 단순한 구조만 나온다. 그래서 탄소 수를 늘려 위의 과정을 반복해보자.
propane의 경우는 간단하니, 바로 butane의 입체 배열에 관해 생각해보자.
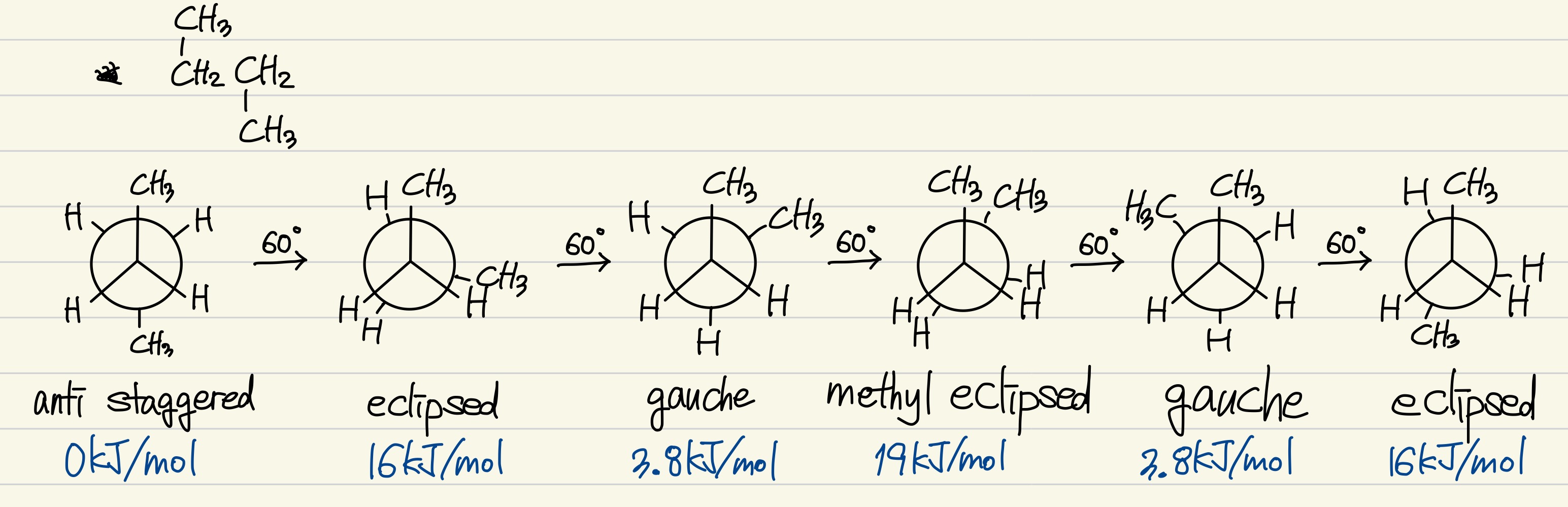
anti staggered 형태
: 최저 에너지 배열을 가지는 형태로, 두 메틸기가 180도를 이루고 있다. 이 형태에서 후면 탄소를 60도 회전시켜보자.
eclipsed 형태
: H-H 가리움에 의한 에너지 불안정 하나와 H-CH3 가리움에 의한 에너지 불안정 두 개가 발생한다. H-H 가리움에 의한 에너지 불안정은 4kJ/mol임을 위에서 알아보았다. 하나의 H-CH3 가리움에 의한 에너지 불안정은 6kJ/mol이다. 따라서 eclipsed 형태는 안티 형태 (anti staggered)에 비해 총 16kJ/mol만큼 불안정해진다. 이 형태에서 다시 후면 탄소를 60도 회전시켜보자.
gauche staggered 형태
: 전면 탄소와 후면 탄소의 두 메틸기가 서로 60도 떨어져 있는 형태이다. 하나의 CH3-CH3 (고쉬)에 의한 에너지 불안정은 3.8kJ/mol이다. 서로 60도를 이루고 있음에도 CH3의 크기 때문에 겹침이 일어나, 에너지 불안정이 발생한다고 생각할 수 있다. 따라서 고쉬 형태는 안티 형태에 비해 총 3.8kJ/mol만큼 불안정해진다. 다시 또 후면 탄소를 60도 회전시켜보자.
methyl eclipsed 형태
: 두 메틸기 사이의 이면각이 0도에 접근하여 생기는 가리움 형태이다. 이 형태는 비틀림 스트레인과 입체 스트레인이 함께 존재한다. 따라서 에너지 불안정은 총 19kJ/mol로 최대이다. 이 methyl eclipsed 형태는 CH3-CH3 가리움 하나와 H-H 가리움 (4kJ/mol) 두 개가 존재한다. 따라서 하나의 CH3-CH3 가리움에 의한 에너지 불안정은 11kJ/mol이다. 다시 또 후면 탄소를 60도 회전시키면 gfauche staggered 형태가, 또 60도 회전시키면 eclipsed 형태가 된다. 지금까지 나온 형태들의 반복이라는 이야기이다.
H-H (가리움) : 4kJ/mol
H-CH3 (가리움) : 6kJ/mol
CH3-CH3 (가리움) : 11kJ/mol
CH-CH3 (고쉬) : 3.8kJ/mol

* 스트레인 종류
1) 결합각 스트레인
: 고리 화합물에서 발생하는 결합각에 의한 스트레인
2) 비틀림 스트레인
: 이웃한 원자에서 결합의 가리움에 의한 스트레인
3) 입체 스트레인
: 두 원자가 너무 가까이 접근했을 때 상호 반발에 의한 스트레인
이것을 에너지 도표로 표현하면 다음과 같이 그릴 수 있다.
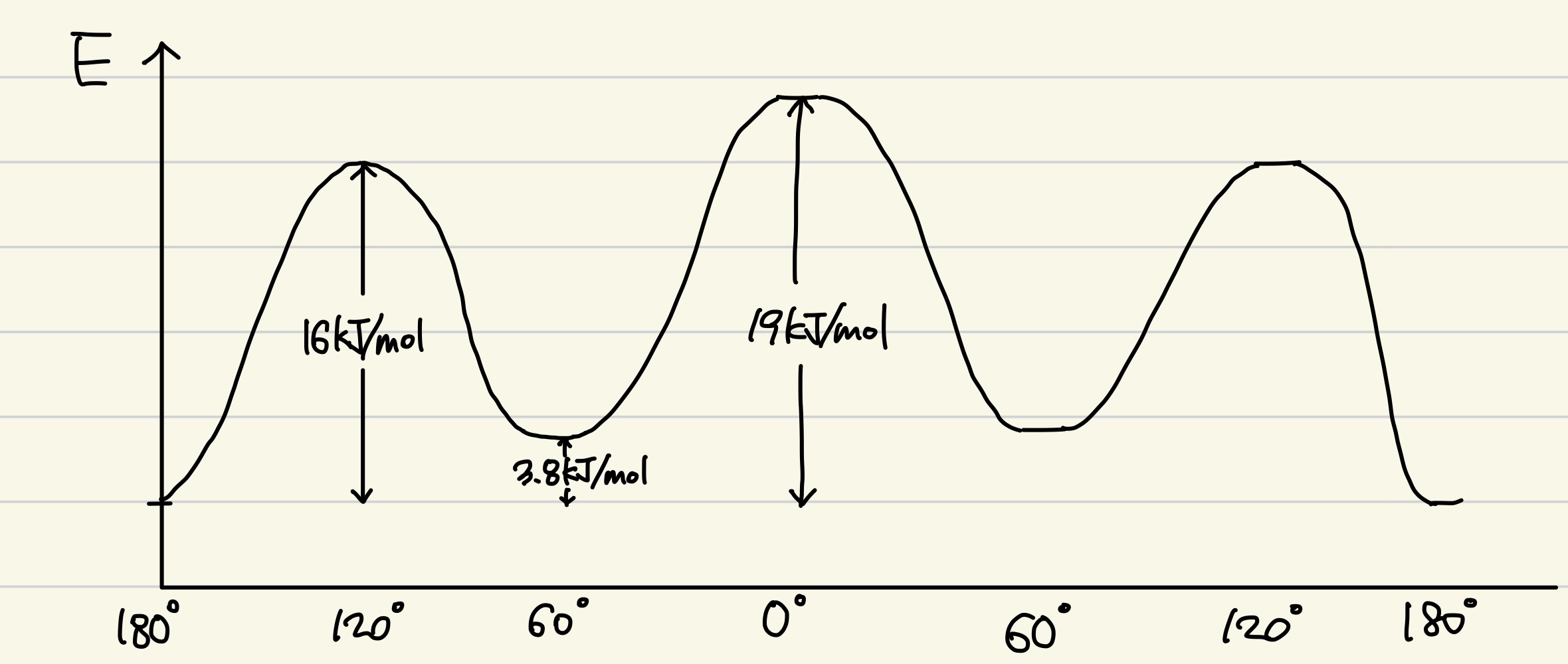
x축은 메틸기 사이의 이면각이고, y축은 에너지이다. 왜 이러한 에너지 도표가 나왔는지 Newman 투영식을 그려보며 생각해보자.
* 수정해야 할 개념, 혹은 표현이 있다면, 댓글에 달아주시면 감사하겠습니다. *
'유기화학' 카테고리의 다른 글
| [유기화학] 알켄 : 반응 및 합성 1 (개요) (0) | 2021.08.17 |
|---|---|
| [유기화학] 극성 양성자성 용매 vs 극성 비양성자성 용매 (polar protic solvent vs polar aprotic solvent) (0) | 2021.08.15 |
| [유기화학] 친핵체 vs 염기 (0) | 2021.08.14 |
| [유기화학] 2. 극성 공유 결합 : 산과 염기 (feat. 형식 전하) (0) | 2021.07.01 |
| [유기화학] 1. 구조와 결합 (feat. 혼성화) (2) | 2021.06.27 |


댓글