이상기체 상태방정식은 식 이름에서 알 수 있듯이 "이상기체"에 적용되는 식이다. 하지만 자연계에는 이상기체처럼 거동하는 기체보다 실제기체가 더 많다. 그렇다면 실제기체에 적용되는 상태방정식은 없을까?
실제기체는 반데르발스 상태방정식 (van der Waals equation of state)으로 설명할 수 있다.
그렇다면 이 식은 이상기체 상태방정식과 어떤 것이 다를까?
이를 이해하기 위해서는 이상기체 상태방정식을 유도할 때 했던 가정을 알아야 한다. 이상기체로 생각하기 위해 했던 가정들이 실제기체에는 적용되지 않기 때문이다.
<이상기체의 가정>
1. 이상기체는 점질량으로 다룬다. 즉, 기체 원자나 분자의 크기를 고려하지 않는다.
2. 이상기체는 서로 상호작용하지 않는다. 즉, 기체 원자나 분자의 인력을 고려하지 않는다.
그렇다면 실제기체에서는 기체 원자나 분자의 크기와 인력을 고려한다는 의미가 된다.
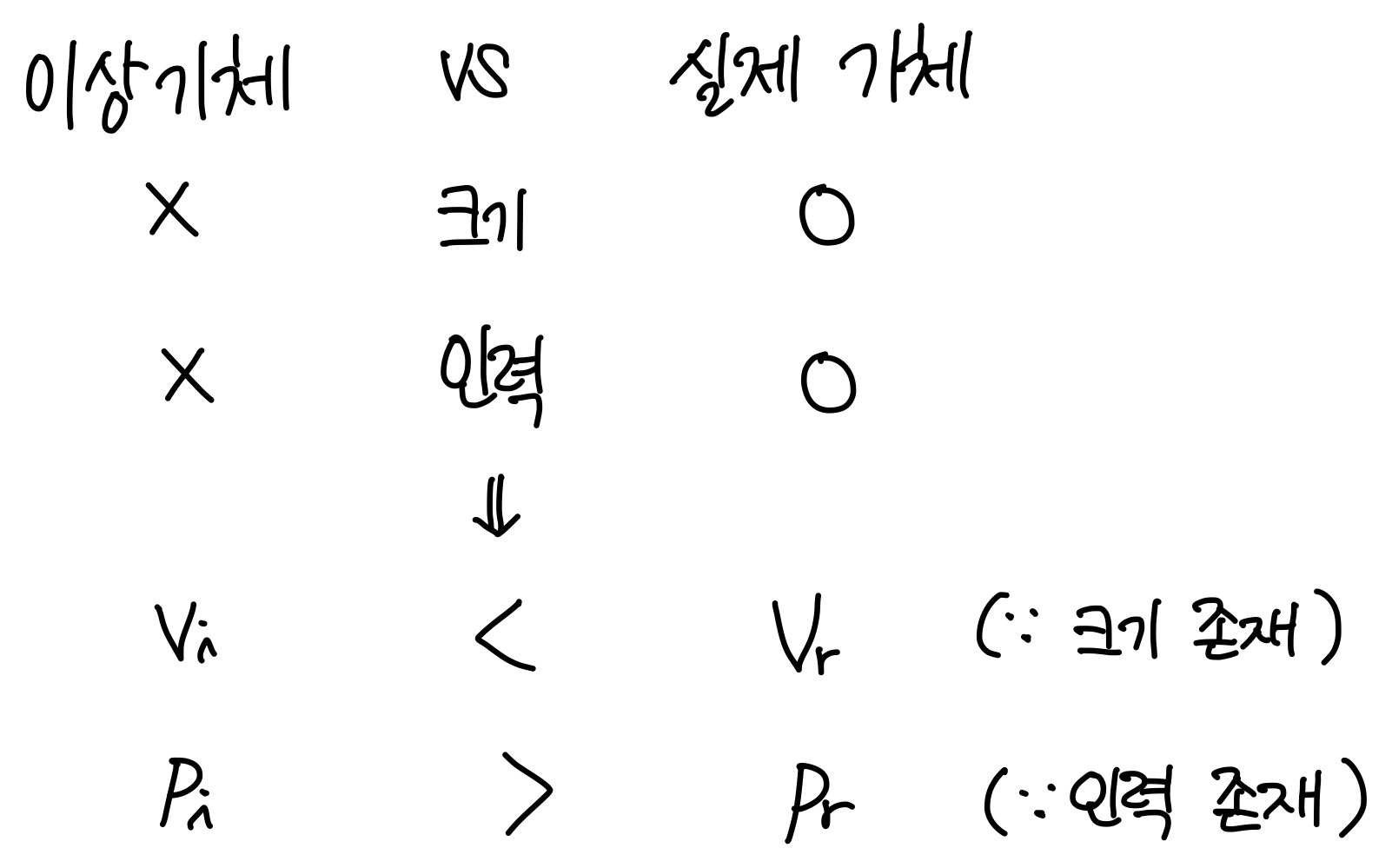
(밑첨자 i는 이상적, ideal의 의미이며, 밑첨자 r은 실제적, real의 의미로 사용하였다.)
크기 반영) 실제기체는 기체 원자나 분자의 크기가 존재한다. 따라서 이상기체보다 실제기체의 부피가 더 크다.
인력 반영) 실제기체는 기체 원자나 분자의 인력이 존재하기 때문에 압력이 낮아진다. 따라서 이상기체보다 실제기체의 압력이 더 작다.
이는 실제기체에서는 기체가 차지하는 부피가 존재하므로, 그만큼의 부피를 빼주어야 이상기체의 부피와 같아진다는 의미이다. 실제압력에서는 기체끼리의 상호작용이 존재하므로, 압력이 낮게 측정된다. 따라서 그만큼의 압력을 더해주어야 이상기체의 압력과 같아진다.
이를 식으로 정리하면 다음과 같다.
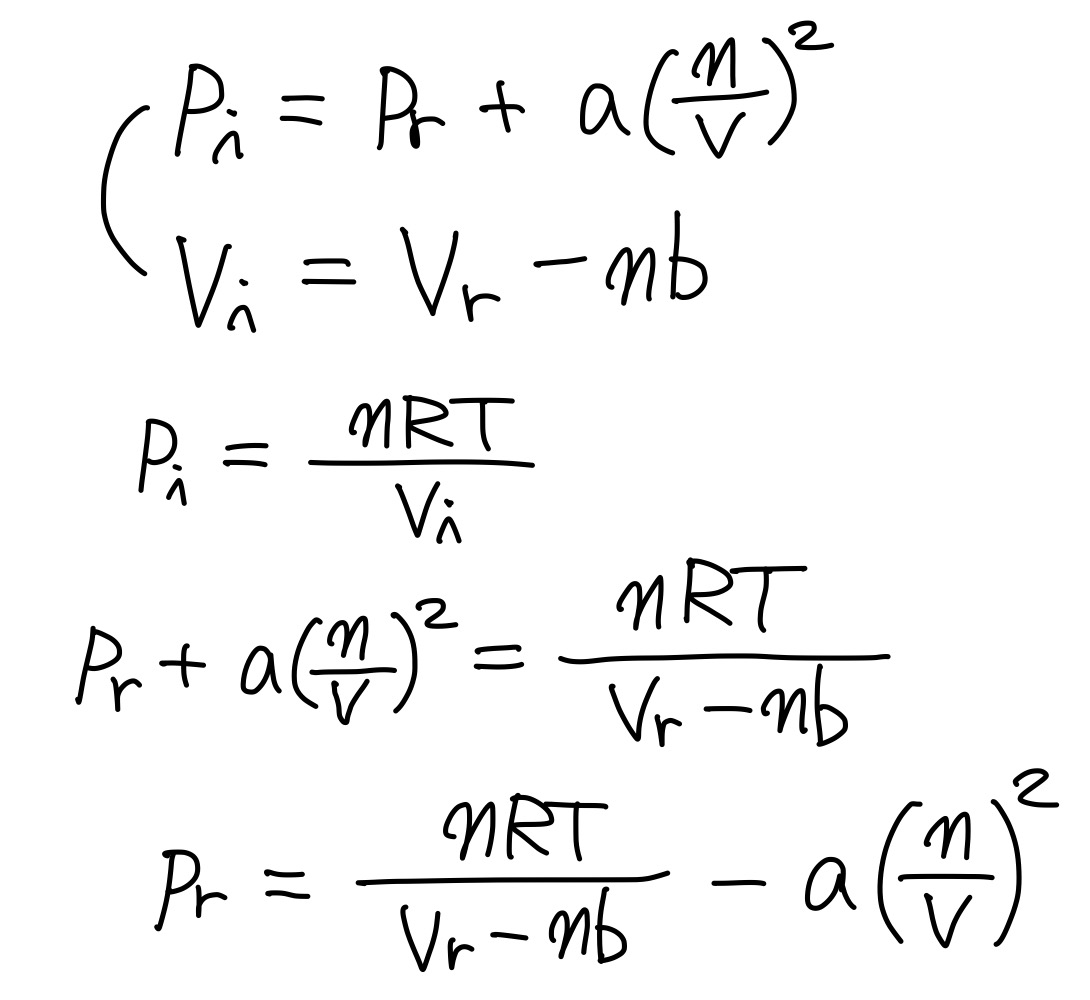
따라서 파라미터 b는 분자의 크기를 고려한 것이고, 파라미터 a는 분자의 인력 상호작용의 세기를 고려한 것이다.
* 수정해야 할 개념, 혹은 표현이 있다면, 댓글에 달아주시면 감사하겠습니다. *
'일반화학' 카테고리의 다른 글
| [일반화학] 1시간만에 일반화학 복습하기 (0) | 2022.02.25 |
|---|---|
| [일반화학] 계와 주위, 그리고 우주 (feat. 계의 종류) (0) | 2021.08.09 |
| [일반화학] 기체의 성질 (0) | 2021.07.02 |


댓글